Les laboratoires d'immuno-hématologie possèdent plusieurs techniques pour rechercher des anticorps irréguliers (RAI), développées ces dernières années et apportant chacune leur intérêt et leurs limites de détection.
Technique saline
Cette technique n'est pas utilisée en technique de routine. Elle est utilisée essentiellement pour mettre en évidence des anticorps ayant une température optimum de 4°C ou 20°C et agglutinant de façon spontanée. On met donc en contact le sérum ou le plasma avec le panel d'hématies O dans des tubes en verre à la température de 4°C. Les tubes sont ensuite centrifugés, puis remis en suspension par agitation douce afin de voir les agglutinations éventuelles. Cette technique met en évidence essentiellement des anticorps de classe IgM.
Magnétisation en microplaque
Les dépistages des recherches d'anticorps irréguliers (RAI) peuvent être réalisés sur des micro-plaques, comme pour la détermination des antigènes de groupe sanguin. Le sérum ou le plasma du patient est mis en contact avec les hématies du panel de dépistage dans des microcupules. Les hématies du panel de dépistage utilisé sont magnétisées selon la méthode breuvetée de Diagast. Après incubation à 37°C, un champ magnétique est appliqué sur la cupule afin que les hématies magnétisées migrent au fond de la cupule. Ces cupules contiennent sur leur paroi des antiglobulines fixant les anticorps IgG éventuellement fixés sur les globules rouges lors de l'incubation. Ces hématies sensibilisées ne migreront pas au fond de la cupule, mais resteront sur les bords. Cette technique ne reconnait que les anticorps de classe IgG, dangereux en transfusion sanguine et chez les foetus.
Immuno-adhérence en microplaque
La recherche des anticorps irréguliers s'effectue sur les microplaques dans lesquelles les hématies tests sont fixées. Le sérum ou plasma du patient est ensuite incubé dans cette plaque à 37°C. Les cupules sont ensuite lavées. Seuls les anticorps fixés sur les hématies tests restent dans les cupules. Afin de révéler la présence de ces anticorps, on y ajoute une antiglobuline de type IgG fixée sur des hématies révélatrices. Après centrifugation, une réaction positive est observée lorsque les hématies révélatrices restent sur les parois des cupules. Une réaction négative est déterminée lorsque tous les globules rouges se retrouvent au fond de la cupule.
Technique par filtration
Cette technique est utilisée, autant en technique manuelle, que par les automates. Cette technique nécessite l'utilisation d'une cassette constituée d'une micro-cupule surmontant une colonne de filtration. Cette colonne de filtration contient des micro-billes ou du gel.
Après avoir mis le sérum ou le plasma du patient dans la cupule au contact des hématies du panel de dépistage ou d'identification, la cassette est incubée à 37°C, puis centrifugée. Lors de cette centrifugation, les globules rouges sont dirigés au fond de la colonne de filtration. Pendant cette phase de migration, les hématies possédant un complexe immun antigène-anticorps vont être bloquées par les billes ou le gel. Elles ne vont donc pas atteindre le fond de la colonne.
Les colonnes de filtration peuvent contenir une antiglobuline humaine polyvalente (anti-IgG et anti-complément) ou une antiglobuline anti-IgG. Les anticorps recherchés ne sont pas les mêmes selon l'antiglobuline utilisée.
Traitement des hématies par les enzymes protéolytiques
Les enzymes protéolytiques, d'origine animale ou végétale (trypsine, papaïne, bromeline, ficine, pronase ...), libèrent des fragments polypeptidiques qui appartiennent aux glycoprotéines. Les hématies ainsi traitées sont alors agglutinables par les anticorps IgG normalement non agglutinants; par exemple, l'IgG anti-RH1 agglutine les hématies traitées par les enzymes; cette propriété n'est pas liée au démasquage de nouveaux déterminants antigéniques.
Le mécanisme en général invoqué pour expliquer l'action des enzymes est celui de la diminution du potentiel zeta du système, du fait que les fragments polypeptidiques libérés contiennent des molécules d'acide sialique, responsables en grande partie de la charge électrique de la membrane.
Test Indirect à l'Antiglobuline (TIA)
Ce test permet, grâce à un sérum antiglobuline humaine (AGH), de révéler la présence d'anticorps spécifiques (donc immunoglobuline) fixés sur l'antigène correspondant à la surface de l'hématie, dans le cas où cette fixation ne s'est pas traduite par l'agglutination directe des hématies.
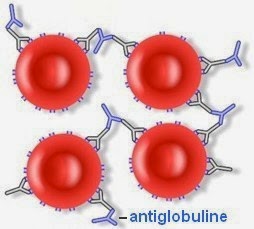
Le TIA est utile dans la détermination de certains phénotypes érythrocytaires ou bien dans la recherche des agglutinines présentes dans le sérum en plaque, en filtration ou en tube et dans l'épreuve de compatibilité. La réaction comporte les deux temps suivants :
- fixation de l'anticorps sur les hématies par l'incubation de la suspension globulaire avec le sérum étudié.
- après éventuellement un lavage des hématies en milieu salin (destiné à éliminer toute trace d'immunoglobulines sériques qui inhiberaient l'antiglobuline), mise en présence du sérum antiglobuline qui provoque l'agglutination en cas de réaction positive.
Les anticorps présents dans une antiglobuline polyvalente doivent avoir une spécificité anti-IgG et anti-complément.